Receptor-tyrosinekinase
Een receptor-tyrosinekinase (RTK) is een membraanreceptor die vele groeifactoren, cytokinen en hormonen kan herkennen. In het menselijke genoom zijn 90 tyrosinekinasegenen geïdentificeerd, waarvan er 58 genen coderen voor receptor-tyrosinekinase eiwitten.[1] Receptor-tyrosinekinasen zijn niet alleen belangrijke regulatoren van normale cellulaire processen, maar spelen ook een cruciale rol in het ontstaan en ontwikkeling van vele soorten kanker.[2] Mutaties in receptor-tyrosinekinasen leiden tot de activering van signaalcascades die grote effecten hebben op de genexpressie.[3]
Een RTK-eiwit is in normale situatie volledig ingebed in een celmembraan. Het extracellulaire domein (de N-terminus) ontvangt en herkent specifieke signalen (liganden) uit het externe milieu van de cel. Het intracellulaire domein (de C-terminus) reageert door signalen af te geven die binnen de cel zorgen voor een biochemische respons.[4]
Functie
Een kinase is een enzym dat fosfaatgroepen van hoogenergetische donormoleculen als ATP overdraagt naar een specifiek doelmolecuul (substraten) in een proces van fosforylering. Het tegenovergestelde, een enzym dat fosfaatgroepen verwijdert van doelmoleculen, is een fosfatase. Kinase-enzymen die specifiek tyrosine-aminozuren fosforyleren, zijn tyrosinekinasen.
-
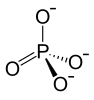 Fosfaat
Fosfaat -
 ATP
ATP -
Als een groeifactor aan het extracellulaire domein van een RTK bindt, zal de RTK dimeriseren met een aangrenzend RTK.[5] Dimerisatie leidt tot activering van de intracellulaire kinasedomeinen van het eiwit in het cytoplasma. Het eerste substraat van deze domeinen is de receptor zelf. Er treedt fosforylering op tussen de intracellulaire domeinen, waarbij het tyrosineresidu fungeert als ontvanger van de fosfaatgroepen. De gefosforyleerde receptor is nu geactiveerd en zal een interactie aangaan met andere eiwitten binnen de cel zodat het signaal wordt doorgegeven.
Zie ook
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Receptor tyrosine kinase op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Referenties
- ↑ Robinson DR, Wu YM, Lin SF (November 2000). The protein tyrosine kinase family of the human genome. Oncogene 19 (49): 5548–57. PMID 11114734. DOI: 10.1038/sj.onc.1203957.
- ↑ Zwick E, Bange J, Ullrich A (September 2001). Receptor tyrosine kinase signalling as a target for cancer intervention strategies. Endocrine-Related Cancer 8 (3): 161–73. PMID 11566607. DOI: 10.1677/erc.0.0080161.
- ↑ Lemmon MA, Schlessinger J (June 2010). Cell signaling by receptor tyrosine kinases. Cell 141 (7): 1117–34. PMID 20602996. PMC 2914105. DOI: 10.1016/j.cell.2010.06.011.
- ↑ Hubbard SR (1999). Structural analysis of receptor tyrosine kinases. Progress in Biophysics and Molecular Biology 71 (3-4): 343–58. PMID 10354703. DOI: 10.1016/S0079-6107(98)00047-9.
- ↑ Lodish (2003). Molecular cell biology, 5th.













