ミカエリス・メンテン式のプロット ミカエリス・メンテン式 (ミカエリス・メンテンしき、英 : Michaelis–Menten equation )とは、酵素の反応速度論 に大きな業績を残したレオノール・ミカエリス とモード・レオノーラ・メンテン にちなんだ、酵素 の反応速度v に関する式で、
v ≡ d [ P ] d t = V m a x [ S ] K m + [ S ] {\displaystyle v\equiv {\frac {d[\mathrm {P} ]}{dt}}={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{\mathrm {m} }+[\mathrm {S} ]}}} で表される。ここで、[P]は反応産物の濃度、[S]は基質 濃度、V max は基質濃度が無限大のときの反応速度である。また、Km はミカエリス・メンテン定数 と言い、v = V max /2(最大速度の半分の速度)を与える基質濃度を表す。この式をもとにしたモデルをミカエリス・メンテン動力学 という。
この式により、反応速度v は
基質濃度が低い([S] ≪ Km )ときはその濃度に比例 基質濃度が高い([S] ≫ Km )ときはその濃度に無関係に最大速度 V max に収束 となることが分かる[1]
導出 迅速平衡法による導出 酵素(以下E)が基質(以下S)と結合して酵素基質複合体(以下ES)を形成、ESがEとSに戻るか反応生成物(以下P)を生成する一連の反応機構を以下のように仮定する。
E + S ⇌ k − 1 k + 1 E S ⟶ k + 2 E + P {\displaystyle \mathrm {E} +\mathrm {S} \,{\overset {k_{+1}}{\underset {k_{-1}}{\rightleftharpoons }}}\,\mathrm {ES} \,{\overset {k_{+2}}{\longrightarrow }}\,\mathrm {E} +\mathrm {P} } この反応は E + S ⇔ E S {\displaystyle \mathrm {E} +\mathrm {S} \Leftrightarrow \mathrm {ES} } E S → E + P {\displaystyle \mathrm {ES} \rightarrow \mathrm {E} +\mathrm {P} } 反応速度定数 を k +2 と設定する。 E + S ⇔ E S {\displaystyle \mathrm {E} +\mathrm {S} \Leftrightarrow \mathrm {ES} } 化学平衡 に達していると仮定し、解離定数 をK s と設定する。
K s = [ E ] [ S ] [ E S ] ⋯ ( 1 ) {\displaystyle K_{\mathrm {s} }={\frac {[\mathrm {E} ][\mathrm {S} ]}{[\mathrm {ES} ]}}\cdots (1)} 仮定されている反応系に存在する酵素種は、基質と結合していない酵素Eと、基質Sと結合した酵素ESの2種類のみなので、全酵素濃度 [E]0 は両者の濃度の和に等しい。
[ E ] + [ E S ] = [ E ] 0 ⋯ ( 2 ) {\displaystyle [\mathrm {E} ]+[\mathrm {ES} ]=[\mathrm {E} ]_{0}\cdots (2)} [ES] を未知数として (1), (2) の連立方程式 を解くと、
[ E S ] = [ E ] 0 [ S ] K s + [ S ] ⋯ ( 3 ) {\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{\mathrm {s} }+[\mathrm {S} ]}}\cdots (3)} 最初に仮定した反応機構では単位時間当たりに産生される反応産物Pの量は酵素基質複合体ESと速度定数 k +2 の積で与えられる。
v = d [ P ] d t = k + 2 [ E S ] ⋯ ( 4 ) {\displaystyle v={\frac {d[\mathrm {P} ]}{dt}}=k_{+2}[\mathrm {ES} ]\cdots (4)} (3) を (4) に代入して、
v = k + 2 [ E ] 0 [ S ] K s + [ S ] ⋯ ( 5 ) {\displaystyle v={\frac {k_{+2}[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{\mathrm {s} }+[\mathrm {S} ]}}\cdots (5)} (4) 式から反応速度v は [ES] に比例することがわかるが、[ES] の最大値は (2) 式より [E]0 である。したがって反応速度v の最大値V max は次式となる。
V m a x = k + 2 [ E ] 0 ⋯ ( 6 ) {\displaystyle V_{\mathrm {max} }=k_{+2}[\mathrm {E} ]_{0}\cdots (6)} (5), (6) より、
v = V m a x [ S ] K s + [ S ] {\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{\mathrm {s} }+[\mathrm {S} ]}}} 定常状態法による導出 系の別の解析がイギリスの植物学者ジョージ・エドワード・ブリッグズ(英語版) とイギリスの遺伝学者J・B・S・ホールデン によって1925年に行われた[2] [3] E + S ⇔ E S {\displaystyle \mathrm {E} +\mathrm {S} \Leftrightarrow \mathrm {ES} } E S → E + P {\displaystyle \mathrm {ES} \rightarrow \mathrm {E} +\mathrm {P} } E + S ⇔ E S {\displaystyle \mathrm {E} +\mathrm {S} \Leftrightarrow \mathrm {ES} }
反応機構は同様で、 E + S ⇔ E S {\displaystyle \mathrm {E} +\mathrm {S} \Leftrightarrow \mathrm {ES} } k +1 、左向きの速度定数をk -1 とする。
定常状態 では各酵素種の経時的濃度変化はないので、
d [ E ] d t = ( k − 1 + k + 2 ) [ E S ] − k + 1 [ E ] [ S ] = 0 ⋯ ( 1 ) d [ E S ] d t = k + 1 [ E ] [ S ] − ( k − 1 + k + 2 ) [ E S ] = 0 ⋯ ( 2 ) {\displaystyle {\begin{aligned}{\frac {d[\mathrm {E} ]}{dt}}&=(k_{-1}+k_{+2})[\mathrm {ES} ]-k_{+1}[\mathrm {E} ][\mathrm {S} ]=0\cdots (1)\\{\frac {d[\mathrm {ES} ]}{dt}}&=k_{+1}[\mathrm {E} ][\mathrm {S} ]-(k_{-1}+k_{+2})[\mathrm {ES} ]=0\cdots (2)\end{aligned}}} この反応機構ではEとESしか酵素種が存在しないので
[ E ] + [ E S ] = [ E ] 0 ⋯ ( 3 ) {\displaystyle [\mathrm {E} ]+[\mathrm {ES} ]=[\mathrm {E} ]_{0}\cdots (3)} 反応産物はESよりk +2 の速度で生成されるので
v = d [ P ] d t = k + 2 [ E S ] ⋯ ( 4 ) {\displaystyle v={\frac {d[\mathrm {P} ]}{dt}}=k_{+2}[\mathrm {ES} ]\cdots (4)} (1) または (2) 式と (3) 式を連立方程式とみなして [ES] を求めると
[ E S ] = k + 1 [ E ] 0 [ S ] k − 1 + k + 2 + k + 1 [ S ] ⋯ ( 5 ) {\displaystyle [\mathrm {ES} ]={\frac {k_{+1}[\mathrm {E} ]_{0}[\mathrm {S} ]}{k_{-1}+k_{+2}+k_{+1}[\mathrm {S} ]}}\cdots (5)} (5) 式を (4) 式に代入して速度v を得た後、分子分母をk +1 で割る。
v = k + 2 [ E ] 0 [ S ] ( k − 1 + k + 2 ) / k + 1 + [ S ] ⋯ ( 6 ) {\displaystyle v={\frac {k_{+2}[\mathrm {E} ]_{0}[\mathrm {S} ]}{(k_{-1}+k_{+2})/k_{+1}+[\mathrm {S} ]}}\cdots (6)} 速度パラメーターとして
V m a x = k + 2 [ E ] 0 , K m = k − 1 + k + 2 k + 1 {\displaystyle V_{\mathrm {max} }=k_{+2}[\mathrm {E} ]_{0},\quad K_{\mathrm {m} }={\frac {k_{-1}+k_{+2}}{k_{+1}}}} と定義すれば、(6) 式は
v = V m a x [ S ] K m + [ S ] {\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{\mathrm {m} }+[\mathrm {S} ]}}} となる。
仮定と限界 導出における第一段階は、自由拡散 を頼りにしている質量作用の法則(英語版) を適用することである。しかし、高濃度のタンパク質 が存在する生細胞の環境では、細胞質 は自由に流れる液体というよりも粘性のあるゲルのように振る舞うことが多く、拡散による分子の動きが制限され、反応速度が変化する[4] [5] フラクタル としてモデル化する方が、その限定された移動性の動力学を表現するのに適している[6]
上記の2つのアプローチによって予測される結果の反応速度は類似しているが、唯一の違いは、迅速平衡近似では定数を K d {\displaystyle K_{d}} K M {\displaystyle K_{\mathrm {M} }}
ε d = k c a t k r ≪ 1 {\displaystyle \varepsilon _{d}={\frac {k_{\mathrm {cat} }}{k_{r}}}\ll 1} の時に妥当である[7]
対照的にブリッグズ・ホールデン準定常状態解析はもし
ε m = [ E ] 0 [ S ] 0 + K M ≪ 1 {\displaystyle \varepsilon _{m}={\frac {\ce {[E]_{0}}}{[{\ce {S}}]_{0}+K_{\ce {M}}}}\ll 1} ならば妥当である[8] [9]
したがって、酵素濃度が基質濃度または K M {\displaystyle K_{\mathrm {M} }}
ミカエリス・メンテン解析、ブリッグズ・ホールデン解析のいずれにおいても、近似の質は ε {\displaystyle \varepsilon \,\!} [7]
重要なことは、不可逆性は扱いやすい解析解を得るために必要な単純化であるが、一般的な場合では生成物の形成は実際には不可逆的ではないということである。酵素反応はより正確には次のように記述される。
E + S ⇌ k r 1 k f 1 ES ⇌ k r 2 k f 2 E + P {\displaystyle {\ce {E{}+S<=>[{\mathit {k_{f_{1}}}}][{\mathit {k_{r_{1}}}}]ES<=>[{\mathit {k_{f_{2}}}}][{\mathit {k_{r_{2}}}}]E{}+P}}} 一般的に、不可逆性の仮定は、以下のいずれかが真である状況で良い仮定である。
1. 基質の濃度が生成物の濃度よりも非常に大きい。 [ S ] ≫ [ P ] ⋅ {\displaystyle {\ce {[S]\gg [P].}}} これは、標準的なin vitro のアッセイ条件でも真であるし、in vivo の多くの生物学的反応、特に生成物が後続の反応によって継続的に除去される場合にも真である。
2. 反応で放出されるエネルギーが非常に大きい、つまり Δ G ≪ 0 {\displaystyle \Delta {G}\ll 0} この2つの条件が成立しない場合(すなわち、反応が低エネルギーであり、生成物のプールがかなり存在する場合)、ミカエリス・メンテン方程式は破綻し、酵素の生物学を理解するためには、順反応と逆反応をあらわに考慮した、より複雑なモデリングアプローチが必要となる。
阻害がある場合のミカエリス・メンテン式 阻害 とは何らかの理由で反応が遅くなることで、酵素反応の阻害には
などの種類がある。両逆数プロット を使うとこれらを見分けることができる。
基質阻害 次の図のように酵素基質複合体がさらに基質と結合して不活性となる場合を言う。
E S + S ⇌ K s s E S S {\displaystyle \mathrm {ES} +\mathrm {S} \,{\overset {K_{\mathrm {ss} }}{\rightleftharpoons }}\,\mathrm {ESS} } この場合の解離定数は
K s s = [ E S ] [ S ] [ E S S ] {\displaystyle K_{\mathrm {ss} }={\frac {[\mathrm {ES} ][\mathrm {S} ]}{[\mathrm {ESS} ]}}} 含まれる酵素種はE、ESとESSの3種類なので、全酵素濃度は
[ E ] 0 = [ E ] + [ E S ] + [ E S S ] {\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {ESS} ]} その他の値は迅速平衡法でミカエリス・メンテン式を求めた時のままで連立方程式を作り [ES] を求めると、
[ E S ] = [ E ] 0 [ S ] K s + [ S ] + [ S ] 2 / K s s {\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{s}+[\mathrm {S} ]+[\mathrm {S} ]^{2}/K_{\mathrm {ss} }}}} これを v = k +2 [ES] に代入しパラメーターV max に変えると、
v = V m a x [ S ] K s + [ S ] + [ S ] 2 / K s s {\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{s}+[\mathrm {S} ]+[\mathrm {S} ]^{2}/K_{\mathrm {ss} }}}} 競合阻害 競合阻害(競争阻害、拮抗阻害とも)とは、基質と阻害剤 (以下、I)が酵素の同じ活性中心に結合する場合に起こる阻害のこと。
反応機構は次式の通り。
E + S ⇌ K s E S ⟶ k + 2 E + P {\displaystyle \mathrm {E} +\mathrm {S} \,{\overset {K_{s}}{\rightleftharpoons }}\,\mathrm {ES} \,{\overset {k_{+2}}{\longrightarrow }}\,\mathrm {E} +\mathrm {P} } E + I ⇌ K i E I {\displaystyle \mathrm {E} +\mathrm {I} \,{\overset {K_{i}}{\rightleftharpoons }}\,\mathrm {EI} } 基質と阻害剤の解離定数は
K i = [ E ] [ I ] [ E I ] {\displaystyle K_{i}={\frac {[\mathrm {E} ][\mathrm {I} ]}{[\mathrm {EI} ]}}} 含まれる酵素種はE、ESとEIの3種類なので、全酵素濃度は
[ E ] 0 = [ E ] + [ E S ] + [ E I ] {\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {EI} ]} 他の値は迅速平衡法で求めた時と同じで連立方程式を作り [ES] を求めると、
[ E S ] = [ E ] 0 [ S ] K s ( 1 + [ I ] / K i ) + [ S ] {\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{s}(1+[\mathrm {I} ]/K_{i})+[\mathrm {S} ]}}} これを v = k +2 [ES] に代入しパラメーターV max に変えると、
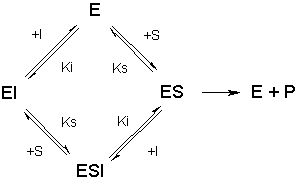
v = V m a x [ S ] ( 1 + [ I ] / K i ) K s + [ S ] {\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{(1+[\mathrm {I} ]/K_{i})K_{s}+[\mathrm {S} ]}}} 非競合阻害 基質と阻害剤が酵素の異なる部位に結合し、両者が互いに他の結合に影響を及ぼさない場合を非競合阻害(非競争阻害、非拮抗阻害とも)という。
反応機構は次の図の通り。
解離定数は、基質が遊離の酵素に結合するときも酵素阻害剤複合体に結合するときも同じで、阻害剤の結合定数も同様なので、
K s = [ E ] [ S ] [ E S ] = [ E I ] [ S ] [ E S I ] K i = [ E ] [ I ] [ E I ] = [ E S ] [ I ] [ E S I ] {\displaystyle {\begin{aligned}K_{s}&={\frac {[\mathrm {E} ][\mathrm {S} ]}{[\mathrm {ES} ]}}={\frac {[\mathrm {EI} ][\mathrm {S} ]}{[\mathrm {ESI} ]}}\\K_{i}&={\frac {[\mathrm {E} ][\mathrm {I} ]}{[\mathrm {EI} ]}}={\frac {[\mathrm {ES} ][\mathrm {I} ]}{[\mathrm {ESI} ]}}\end{aligned}}} 反応機構の中にある酵素種はE、ES、EIとESIの4種類なので、全酵素濃度は
[ E ] 0 = [ E ] + [ E S ] + [ E I ] + [ E S I ] {\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {EI} ]+[\mathrm {ESI} ]} この3つの式で連立方程式を作り、[ES] について求めると、
[ E S ] = [ E ] 0 [ S ] ( 1 + [ I ] / K i ) ( K s + [ S ] ) {\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{(1+[\mathrm {I} ]/K_{i})(K_{s}+[\mathrm {S} ])}}} これを v = k +2 [ES] に代入しパラメーターV max に変えると、
v = V m a x 1 + [ I ] / K i [ S ] K s + [ S ] {\displaystyle v={\frac {{\frac {V_{\mathrm {max} }}{1+[\mathrm {I} ]/K_{i}}}[\mathrm {S} ]}{K_{s}+[\mathrm {S} ]}}} 不競合阻害 基質と阻害剤が酵素の異なる部位に結合するが、阻害剤は遊離の酵素には結合できず、酵素基質複合体のみに結合できる場合を不競合阻害(不競争阻害、不拮抗阻害とも)という。
反応機構は次の図の通り。
解離定数は、
K s = [ E ] [ S ] [ E S ] {\displaystyle K_{s}={\frac {[\mathrm {E} ][\mathrm {S} ]}{[\mathrm {ES} ]}}} K i = [ E S ] [ I ] [ E S I ] {\displaystyle K_{i}={\frac {[\mathrm {ES} ][\mathrm {I} ]}{[\mathrm {ESI} ]}}} 反応機構の中にある酵素種はE、ES、ESIの3種類なので、全酵素濃度は
[ E ] 0 = [ E ] + [ E S ] + [ E S I ] {\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {ESI} ]} この3つの式から連立方程式を作り、[ES] について求めると、
[ E S ] = [ E ] 0 [ S ] K s + ( 1 + [ I ] / K i ) [ S ] {\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{s}+(1+[\mathrm {I} ]/K_{i})[\mathrm {S} ]}}} これを v = k +2 [ES] に代入しパラメーターV max に変えると、
v = V m a x 1 + [ I ] / K i [ S ] K s 1 + [ I ] / K i + [ S ] {\displaystyle v={\frac {{\frac {V_{\mathrm {max} }}{1+[\mathrm {I} ]/K_{i}}}[\mathrm {S} ]}{{\frac {K_{s}}{1+[I]/K_{i}}}+[\mathrm {S} ]}}} 混合型阻害 定数の決定 定数 V max {\displaystyle V_{\max }} K M {\displaystyle K_{\mathrm {M} }} [ S ] {\displaystyle [S]} v 0 {\displaystyle v_{0}} [8] 非線形回帰 を用いることで、パラメータを得ることができる[10]
非線形回帰を行うための計算機が利用できるようになる前は、方程式の線形化を伴うグラフ的な方法が用いられていた。イーディー=ホフステー図 、ヘインズ=ウルフプロット 、ラインウィーバー=バークプロット などが提案されており、これらの中ではヘインズ=ウルフプロットが最も正確である[10] [11] v 0 {\displaystyle v_{0}} 誤差 d v 0 {\displaystyle dv_{0}} 1 / v 0 {\displaystyle 1/v_{0}} d v 0 / v 0 2 {\displaystyle dv_{0}/v_{0}^{2}} 不確かさの伝播(英語版) )。 d v 0 {\displaystyle dv_{0}} 最小二乗法 を用いた回帰分析 は、誤差が正規分布 していることを前提としているが、これは v 0 {\displaystyle v_{0}} [12]
その他、歴史的にはコーニッシュボーデンの直接的直線プロット[13]
1997年、サンティアゴ・シュネル(英語版) とClaudio Mendozaは、ミカエリス・メンテン反応速度論の経時的反応速度解析のために、ランベルトのW関数 の解に基づいた閉形式解を提案した[14]
[ S ] K M = W ( F ( t ) ) {\displaystyle {\frac {[{\ce {S}}]}{K_{\mathrm {M} }}}=W(F(t))} 上式においてW はランベルトのW関数、
F ( t ) = [ S ] 0 K M exp ( [ S ] 0 K M − V max K M t ) {\displaystyle F(t)={\frac {[{\ce {S}}]_{0}}{K_{\mathrm {M} }}}\exp \!\left({\frac {[{\ce {S}}]_{0}}{K_{\mathrm {M} }}}-{\frac {V_{\max }}{K_{\mathrm {M} }}}\,t\right)} である。
上記の方程式は経時データから V max {\displaystyle V_{\max }} K M {\displaystyle K_{\mathrm {M} }} [15] [16]
参考文献 ^ 大竹伝雄『化学工学Ⅲ』岩波書店、1978年、16頁。ISBN 4-00-021103-X。 ^ Briggs, G.E.; Haldane, J.B.S. (1925). “A note on the kinematics of enzyme action”. Biochem J 19 (2): 338–339. doi:10.1042/bj0190338. PMC 1259181. PMID 16743508. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1259181/ . ^ Laidler, Keith J. (1978). Physical Chemistry with Biological Applications . Benjamin/Cummings. pp. 428–430. ISBN 0-8053-5680-0 ^ Zhou, H.X.; Rivas, G.; Minton, A.P. (2008). “Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences”. Annu Rev Biophys 37 (1): 375–97. doi:10.1146/annurev.biophys.37.032807.125817. PMC 2826134. PMID 18573087. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2826134/ . ^ Grima, R.; Schnell, S. (Oct 2006). “A systematic investigation of the rate laws valid in intracellular environments”. Biophys Chem 124 (1): 1–10. doi:10.1016/j.bpc.2006.04.019. PMID 16781049. ^ Schnell, S.; Turner, T.E. (2004). “Reaction kinetics in intracellular environments with macromolecular crowding: simulations and rate laws”. Prog Biophys Mol Biol 85 (2–3): 235–60. doi:10.1016/j.pbiomolbio.2004.01.012. PMID 15142746. ^ a b Keener, J.; Sneyd, J. (2008). Mathematical Physiology: I: Cellular Physiology (2 ed.). Springer. ISBN 978-0-387-75846-6 ^ a b Segel, L.A.; Slemrod, M. (1989). “The quasi-steady-state assumption: A case study in perturbation”. SIAM Review 31 (3): 446–477. doi:10.1137/1031091. https://zenodo.org/record/1059052 . ^ Murray, J.D. (2002). Mathematical Biology: I. An Introduction (3 ed.). Springer. ISBN 978-0-387-95223-9 ^ a b Leskovac, V. (2003). Comprehensive enzyme kinetics . New York: Kluwer Academic/Plenum Pub.. ISBN 978-0-306-46712-7 ^ Greco, W.R.; Hakala, M.T. (1979). “Evaluation of methods for estimating the dissociation constant of tight binding enzyme inhibitors”. J Biol Chem 254 (23): 12104–12109. doi:10.1016/S0021-9258(19)86435-9. PMID 500698. ^ Hayakawa, K.; Guo, L.; Terentyeva, E.A.; Li, X.K.; Kimura, H.; Hirano, M.; Yoshikawa, K.; Nagamine, T. et al. (2006). “Determination of specific activities and kinetic constants of biotinidase and lipoamidase in LEW rat and Lactobacillus casei (Shirota)”. J Chromatogr B 844 (2): 240–50. doi:10.1016/j.jchromb.2006.07.006. PMID 16876490. ^ 知名秀泰、岡田豊「原典からの酵素反応速度論」『生物工学』第82巻第1号、2014年、20–25頁。 ^ Schnell, S.; Mendoza, C. (1997). “A closed form solution for time-dependent enzyme kinetics”. Journal of Theoretical Biology 187 (2): 207–212. Bibcode: 1997JThBi.187..207S. doi:10.1006/jtbi.1997.0425. ^ Goudar, C. T.; Sonnad, J. R.; Duggleby, R. G. (1999). “Parameter estimation using a direct solution of the integrated Michaelis–Menten equation”. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology 1429 (2): 377–383. doi:10.1016/s0167-4838(98)00247-7. PMID 9989222. ^ Goudar, C. T.; Harris, S. K.; McInerney, M. J.; Suflita, J. M. (2004). “Progress curve analysis for enzyme and microbial kinetic reactions using explicit solutions based on the Lambert W function”. Journal of Microbiological Methods 59 (3): 317–326. doi:10.1016/j.mimet.2004.06.013. PMID 15488275. 関連項目 外部リンク 
![{\displaystyle v\equiv {\frac {d[\mathrm {P} ]}{dt}}={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{\mathrm {m} }+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a642b45fa884d803322295e6a12a5806cf20545e)



![{\displaystyle K_{\mathrm {s} }={\frac {[\mathrm {E} ][\mathrm {S} ]}{[\mathrm {ES} ]}}\cdots (1)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/17d5142a40d296f152c9cac4e010f91c3b7ccdc5)
![{\displaystyle [\mathrm {E} ]+[\mathrm {ES} ]=[\mathrm {E} ]_{0}\cdots (2)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3707b2e367d6f8edd759b4759dacff91258275ff)
![{\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{\mathrm {s} }+[\mathrm {S} ]}}\cdots (3)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/251d081a60fea6c94feffba1fe161a3b4ba91616)
![{\displaystyle v={\frac {d[\mathrm {P} ]}{dt}}=k_{+2}[\mathrm {ES} ]\cdots (4)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05b0147175d00de74e14bef62d64ca9f32f0cbce)
![{\displaystyle v={\frac {k_{+2}[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{\mathrm {s} }+[\mathrm {S} ]}}\cdots (5)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/17a0585016cd295d2ae9c690bd33fdac0af6424f)
![{\displaystyle V_{\mathrm {max} }=k_{+2}[\mathrm {E} ]_{0}\cdots (6)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/71b0a99deb51b2a5a028989ebbce76bbb9ef4e5d)
![{\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{\mathrm {s} }+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9a068b32cc5d24632b16caa8fe3a59d552c98d08)
![{\displaystyle {\begin{aligned}{\frac {d[\mathrm {E} ]}{dt}}&=(k_{-1}+k_{+2})[\mathrm {ES} ]-k_{+1}[\mathrm {E} ][\mathrm {S} ]=0\cdots (1)\\{\frac {d[\mathrm {ES} ]}{dt}}&=k_{+1}[\mathrm {E} ][\mathrm {S} ]-(k_{-1}+k_{+2})[\mathrm {ES} ]=0\cdots (2)\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/86004e4a0bd4787669d7e6fc399a3021c73c80a6)
![{\displaystyle [\mathrm {E} ]+[\mathrm {ES} ]=[\mathrm {E} ]_{0}\cdots (3)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/de7fbf78d40d37cf336f83b0eafa4edb64dc7ba4)
![{\displaystyle [\mathrm {ES} ]={\frac {k_{+1}[\mathrm {E} ]_{0}[\mathrm {S} ]}{k_{-1}+k_{+2}+k_{+1}[\mathrm {S} ]}}\cdots (5)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32d82455a7302b806a96ada66a69a800c1b9effe)
![{\displaystyle v={\frac {k_{+2}[\mathrm {E} ]_{0}[\mathrm {S} ]}{(k_{-1}+k_{+2})/k_{+1}+[\mathrm {S} ]}}\cdots (6)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b971178c678ade33784d084614343078bc278dc3)
![{\displaystyle V_{\mathrm {max} }=k_{+2}[\mathrm {E} ]_{0},\quad K_{\mathrm {m} }={\frac {k_{-1}+k_{+2}}{k_{+1}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5174abe388c59eddd1265ece21a176f70e5251a7)
![{\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{\mathrm {m} }+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e921c0fc39f0bf60515f81743a437de6e766ecc)



![{\displaystyle \varepsilon _{m}={\frac {\ce {[E]_{0}}}{[{\ce {S}}]_{0}+K_{\ce {M}}}}\ll 1}](https://wikimedia.org/api/rest_v1/media/math/render/svg/372346701f20beb9273f769c7b4b65d57d90bf8f)

![{\displaystyle {\ce {E{}+S<=>[{\mathit {k_{f_{1}}}}][{\mathit {k_{r_{1}}}}]ES<=>[{\mathit {k_{f_{2}}}}][{\mathit {k_{r_{2}}}}]E{}+P}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ecd82f37f2f016120b490ee0c5a2758d53ad240a)
![{\displaystyle {\ce {[S]\gg [P].}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6505b0b596821fdbe306e0357a8a25fcb0246f1a)


![{\displaystyle K_{\mathrm {ss} }={\frac {[\mathrm {ES} ][\mathrm {S} ]}{[\mathrm {ESS} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/12236f6c5b196d303a81e407d2edb6f0ce14bd6f)
![{\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {ESS} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c92884871cbe73877ad1395c1170adf8eb24fd11)
![{\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{s}+[\mathrm {S} ]+[\mathrm {S} ]^{2}/K_{\mathrm {ss} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e51e714e0f42635a8e3ff0c6c8009b70b923bf7)
![{\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{K_{s}+[\mathrm {S} ]+[\mathrm {S} ]^{2}/K_{\mathrm {ss} }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b243591b9ec529858aeef558908e4ab8ed72f8db)


![{\displaystyle K_{i}={\frac {[\mathrm {E} ][\mathrm {I} ]}{[\mathrm {EI} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db5837522db302ab6c8ab5d3ccb615fdb637320f)
![{\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {EI} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd6563644f144224380bd86b3d591b9c43427af5)
![{\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{s}(1+[\mathrm {I} ]/K_{i})+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fdfec607ca3544fc39669b38ccf06b3262cc8402)
![{\displaystyle v={\frac {V_{\mathrm {max} }[\mathrm {S} ]}{(1+[\mathrm {I} ]/K_{i})K_{s}+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f913cd8d4d75534690a39f5eaf2c6808a1791f56)
![{\displaystyle {\begin{aligned}K_{s}&={\frac {[\mathrm {E} ][\mathrm {S} ]}{[\mathrm {ES} ]}}={\frac {[\mathrm {EI} ][\mathrm {S} ]}{[\mathrm {ESI} ]}}\\K_{i}&={\frac {[\mathrm {E} ][\mathrm {I} ]}{[\mathrm {EI} ]}}={\frac {[\mathrm {ES} ][\mathrm {I} ]}{[\mathrm {ESI} ]}}\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/da51111d10c1e1aeaba0b4422cb729177ef7ce4c)
![{\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {EI} ]+[\mathrm {ESI} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7eaeb766a4ed004c7154a69deb6775b0acb8857d)
![{\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{(1+[\mathrm {I} ]/K_{i})(K_{s}+[\mathrm {S} ])}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66df951bf1a53fca9782fc8931937a7c70ca4f0d)
![{\displaystyle v={\frac {{\frac {V_{\mathrm {max} }}{1+[\mathrm {I} ]/K_{i}}}[\mathrm {S} ]}{K_{s}+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56f49b2de11bb733fd46eaa459f54ffd4f9b3335)

![{\displaystyle K_{s}={\frac {[\mathrm {E} ][\mathrm {S} ]}{[\mathrm {ES} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6b6d6037778020a06da336af201ace8060d8743)
![{\displaystyle K_{i}={\frac {[\mathrm {ES} ][\mathrm {I} ]}{[\mathrm {ESI} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/50eb5902d7edf5ef4a983eb77c0fa5232b803a7d)
![{\displaystyle [\mathrm {E} ]_{0}=[\mathrm {E} ]+[\mathrm {ES} ]+[\mathrm {ESI} ]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2fa5ed21c70d2137d998aaaaa4d3228578e53e0e)
![{\displaystyle [\mathrm {ES} ]={\frac {[\mathrm {E} ]_{0}[\mathrm {S} ]}{K_{s}+(1+[\mathrm {I} ]/K_{i})[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1a24c7340f48a83a16e547d8aa92db1dfc33153b)
![{\displaystyle v={\frac {{\frac {V_{\mathrm {max} }}{1+[\mathrm {I} ]/K_{i}}}[\mathrm {S} ]}{{\frac {K_{s}}{1+[I]/K_{i}}}+[\mathrm {S} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d5d8b5dcdaa7e35147a06ee750ad05d578737a0b)

![{\displaystyle [S]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/292bbb82029aa583c5d2ac5fa1d7e4fedf537d8b)




![{\displaystyle {\frac {[{\ce {S}}]}{K_{\mathrm {M} }}}=W(F(t))}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59550e611942c967598349030e8f35cdf05e198b)
![{\displaystyle F(t)={\frac {[{\ce {S}}]_{0}}{K_{\mathrm {M} }}}\exp \!\left({\frac {[{\ce {S}}]_{0}}{K_{\mathrm {M} }}}-{\frac {V_{\max }}{K_{\mathrm {M} }}}\,t\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/51b8231f6b731073064d0cb2b4c4e3e541813626)






