Serium(III) klorida
 | |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC Serium(III) klorida Serium triklorida | |||
| Nama lain Sero klorida | |||
| Penanda | |||
Nomor CAS |
| ||
Model 3D (JSmol) |
| ||
| 3DMet | {{{3DMet}}} | ||
| ChEBI |
| ||
| ChemSpider |
| ||
| Nomor EC | |||
| Referensi Gmelin | 1828 | ||
PubChem CID |
| ||
| Nomor RTECS | {{{value}}} | ||
| UNII |
| ||
CompTox Dashboard (EPA) |
| ||
InChI
| |||
SMILES
| |||
| Sifat | |||
Rumus kimia | CeCl3 | ||
| Massa molar | 246,48 g/mol (anhidrat) 372,58 g/mol (heptahidrat) | ||
| Penampilan | Bubuk putih halus | ||
| Densitas | 3,97 g/cm3 | ||
| Titik lebur | 817 °C (1.503 °F; 1.090 K) (anhidrat) 90 °C (heptahidrat, terurai) | ||
| Titik didih | 1.727 °C (3.141 °F; 2.000 K) | ||
Kelarutan dalam air | 100 g/100 ml | ||
| Kelarutan | Larut dalam alkohol | ||
| +2490,0·10−6 cm3/mol | |||
| Struktur | |||
| Heksagonal (jenis UCl3), hP8 | |||
| P63/m, No. 176 | |||
| prisma trigonal bertudung-tiga (9-koordinat) | |||
| Bahaya | |||
| Piktogram GHS |    | ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H315, H318, H319, H335, H410 | |||
| P261, P264, P271, P273, P280, P302+352, P304+340, P305+351+338, P310, P312, P321, P332+313, P337+313, P362, P391, P403+233, P405, P501 | |||
| Titik nyala | Tak mudah terbakar | ||
| Senyawa terkait | |||
Anion lain | Serium(III) oksida Serium(III) fluorida Serium(III) bromida Serium(III) iodida | ||
Kation lainnya | Lantanum(III) klorida Praseodimium(III) klorida | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
 N verifikasi (apa ini N verifikasi (apa ini  Y Y N ?) N ?) | |||
| Referensi | |||
Serium(III) klorida (CeCl3), juga dikenal sebagai serium triklorida atau sero klorida, adalah sebuah senyawa anorganik dari serium dan klorin. Senyawa ini adalah garam higroskopis berwarna putih; garam ini akan dengan cepat menyerap air jika terpapar udara lembap untuk membentuk hidrat, yang tampaknya memiliki komposisi yang bervariasi,[1] meskipun heptahidratnya (CeCl3·7H2O) telah diketahui. Ia sangat larut dalam air, serta (saat dalam bentuk anhidrat) larut dalam etanol dan aseton.[2]
Pembuatan CeCl3 anhidrat
Pemanasan cepat sederhana dari hidrat saja dapat menyebabkan sejumlah kecil hidrolisis.[3]
Bentuk CeCl3 anhidrat yang berguna dapat dibuat dengan memanaskan bentuk heptahidrat secara bertahap hingga suhu 140 °C (284 °F) selama berjam-jam di bawah vakum, jika dilakukan dengan hati-hati.[2][4][5] Ini mungkin atau mungkin tidak mengandung sedikit CeOCl dari hidrolisis, tetapi cocok untuk digunakan dengan reagen organolitium dan Grignard. CeCl3 anhidrat murni dapat dibuat melalui dehidrasi bentuk hidrat baik dengan memanaskannya secara perlahan hingga suhu 400 °C (752 °F) dengan 4–6 ekuivalen amonium klorida di bawah vakum tinggi,[3][6][7][8] atau dengan memanaskannya dengan tionil klorida berlebih selama tiga jam.[3][9] Senyawa halida anhidrat ini dapat dibuat dari logam serium dan hidrogen klorida.[10][11] Senyawa ini biasanya dimurnikan melalui sublimasi suhu tinggi di bawah vakum tinggi. Ekstraksi Soxhlet terhadap CeCl
3 dengan thf menghasilkan CeCl3(thf)1,04.[12]
Kegunaan
Serium(III) klorida dapat digunakan sebagai titik awal untuk pembuatan garam serium lainnya, seperti asam Lewis serium(III) trifluorometanasulfonat.[13]
Sintesis organik
Serium(III) klorida adalah reagen dalam beberapa prosedur yang digunakan dalam sintesis organik.[14] Reduksi Luche[15] dari alfa-, beta-senyawa karbonil tak jenuh telah menjadi metode yang populer dalam sintesis organik, di mana CeCl3·7H2O digunakan bersama dengan natrium borohidrida. Sebagai contoh, karvona hanya menghasilkan alkohol alilik 1 dan tidak ada alkohol jenuh 2. Tanpa CeCl3, campuran 1 dan 2 akan terbentuk.

Senyawa ini juga dapat mendeproteksi gugus MEM menjadi alkohol dengan adanya gugus proteksi asetal lainnya (misalnya THP).
Penggunaan penting lainnya dalam sintesis organik adalah untuk alkilasi keton, yang jika tidak, akan membentuk enolat jika reagen organolitium sederhana digunakan. Sebagai contoh, senyawa 3 diperkirakan hanya membentuk enolat tanpa adanya CeCl3, tetapi dengan adanya CeCl3 alkilasi yang mulus terjadi:[4]
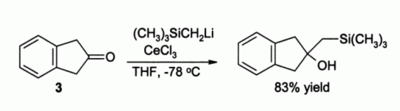
Dilaporkan bahwa dalam reaksi ini, reagen organolitium bekerja lebih efektif dibandingkan dengan reagen Grignard.[4]
Referensi
- ^ Beberapa produsen besar seperti Alfa dan Strem mencantumkan produk mereka hanya sebagai "hidrat" dengan "xH2O" dalam rumusnya, tetapi Aldrich menjual heptahidrat.
- ^ a b Paquette, L. A. (1999). Coates, R. M.; Denmark, S. E., ed. Handbook of Reagents for Organic Synthesis: Reagents, Auxiliaries and Catalysts for C-C Bond Formation. New York: Wiley. ISBN 0-471-97924-4.
- ^ a b c Edelmann, F. T.; Poremba, P. (1997). Herrmann, W. A., ed. Synthetic Methods of Organometallic and Inorganic Chemistry. VI. Stuttgart: Georg Thieme Verlag. ISBN 3-13-103021-6.
- ^ a b c Johnson, C. R.; Tait, B. D. (1987). "A cerium(III) modification of the Peterson reaction: methylenation of readily enolizable carbonyl compounds". Journal of Organic Chemistry. 52 (2): 281–283. doi:10.1021/jo00378a024. ISSN 0022-3263.
- ^ Dimitrov, Vladimir; Kostova, Kalina; Genov, Miroslav (1996). "Anhydrous cerium(III) chloride — Effect of the drying process on activity and efficiency". Tetrahedron Letters. 37 (37): 6787–6790. doi:10.1016/S0040-4039(96)01479-7.
- ^ Taylor, M. D.; Carter, P. C. (1962). "Preparation of anhydrous lanthanide halides, especially iodides". Journal of Inorganic and Nuclear Chemistry. 24 (4): 387–391. doi:10.1016/0022-1902(62)80034-7.
- ^ Kutscher, J.; Schneider, A. (1971). "Notiz zur Präparation von wasserfreien Lanthaniden-Haloge-niden, Insbesondere von Jodiden". Inorg. Nucl. Chem. Lett. 7 (9): 815. doi:10.1016/0020-1650(71)80253-2.
- ^ Greenwood, N. N.; Earnshaw, A. (1984). Chemistry of the Elements. New York: Pergamon Press. ISBN 0-08-022056-8.
- ^ Freeman, J. H.; Smith, M. L. (1958). "The preparation of anhydrous inorganic chlorides by dehydration with thionyl chloride". Journal of Inorganic and Nuclear Chemistry. 7 (3): 224–227. doi:10.1016/0022-1902(58)80073-1.
- ^ Druding, L. F.; Corbett, J. D. (1961). "Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide". Journal of the American Chemical Society. 83 (11): 2462–2467. doi:10.1021/ja01472a010. ISSN 0002-7863.
- ^ Corbett, J. D. (1973). "Reduced Halides of the Rare Earth Elements". Rev. Chim. Minérale. 10: 239.
- ^ Hirneise, Lars; Buschmann, Dennis A.; Maichle-Mössmer, Cäcilia; Anwander, Reiner (2022). "Cerium Fluorenyl Complexes Including CC Coupling Reactions". Organometallics. 41 (8): 962–976. doi:10.1021/acs.organomet.2c00029. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - ^ Mine, Norioki; Fujiwara, Yuzo; Taniguchi, Hiroshi (1986). "Trichlorolanthanoid (LnCl3)-catalyzed Friedel-Crafts alkylation reactions". Chemistry Letters. 15 (3): 357–360. doi:10.1246/cl.1986.357.
- ^ Paquette, Leo A.; Sabitha, G.; Yadav, J. S.; Scheuermann, Angelique M.; Merchant, Rohan R. (2021). "Cerium(III) Chloride". Encyclopedia of Reagents for Organic Synthesis. hlm. 1–15. doi:10.1002/047084289X.rc041.pub3. ISBN 9780471936237.
- ^ Luche, Jean-Louis; Rodriguez-Hahn, Lydia; Crabbé, Pierre (1978). "Reduction of natural enones in the presence of cerium trichloride". Journal of the Chemical Society, Chemical Communications (14): 601–602. doi:10.1039/C39780000601.
Bacaan lebih lanjut
- CRC Handbook of Chemistry and Physics (58th edition), CRC Press, West Palm Beach, Florida, 1977.
- Anwander, R. (1999). Kobayashi, S., ed. Lanthanides: Chemistry and Use in Organic Synthesis. Berlin: Springer-Verlag. hlm. 10–12. ISBN 9783540645269.
- l
- b
- s
- CeI2
- CeSe
- CeBr3
- Ce2(CO3)3
- CeCl3
- CeF3
- CeI3
- Ce(OH)3
- CeN
- Ce2O3
- Ce2(SO4)3
- Ce2(SeO4)3
- Ce2S3
- CeP
- Ce(NO3)3
- Ce(ClO4)3
| Organoserium(III) |
|
|---|
- Ce3O4
- CeS
- (NH4)4Ce(SO4)4•2 H2O
- (NH4)2Ce(NO3)6
- CeB6
- Ce(NO3)4
- Ce(OH)4
- CeO2
- Ce(SO4)2
- Ce(SeO4)2
- CeF4
- Ce(ClO4)4
- l
- b
- s
| HCl | He | ||||||||||||||||
| LiCl | BeCl2 | BCl3 B2Cl4 | CCl4 | NCl3 ClN3 | Cl2O ClO2 Cl2O7 | ClF ClF3 ClF5 | Ne | ||||||||||
| NaCl | MgCl2 | AlCl AlCl3 | SiCl4 | P2Cl4 PCl3 PCl5 | S2Cl2 SCl2 SCl4 | Cl2 | Ar | ||||||||||
| KCl | CaCl CaCl2 | ScCl3 | TiCl2 TiCl3 TiCl4 | VCl2 VCl3 VCl4 VCl5 | CrCl2 CrCl3 CrCl4 | MnCl2 | FeCl2 FeCl3 | CoCl2 CoCl3 | NiCl2 | CuCl CuCl2 | ZnCl2 | GaCl2 GaCl3 | GeCl2 GeCl4 | AsCl3 AsCl5 | Se2Cl2 SeCl4 | BrCl | KrCl |
| RbCl | SrCl2 | YCl3 | ZrCl3 ZrCl4 | NbCl4 NbCl5 | MoCl2 MoCl3 MoCl4 MoCl5 MoCl6 | TcCl4 | RuCl3 | RhCl3 | PdCl2 | AgCl | CdCl2 | InCl InCl2 InCl3 | SnCl2 SnCl4 | SbCl3 SbCl5 | Te3Cl2 TeCl4 | ICl ICl3 | XeCl XeCl2 |
| CsCl | BaCl2 | HfCl4 | TaCl5 | WCl2 WCl3 WCl4 WCl5 WCl6 | Re3Cl9 ReCl4 ReCl5 ReCl6 | OsCl4 | IrCl2 IrCl3 IrCl4 | PtCl2 PtCl4 | AuCl AuCl3 | Hg2Cl2, HgCl2 | TlCl | PbCl2, PbCl4 | BiCl3 | PoCl2, PoCl4 | AtCl | RnCl2 | |
| FrCl | RaCl2 | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| LaCl3 | CeCl3 | PrCl3 | NdCl2, NdCl3 | PmCl3 | SmCl2, SmCl3 | EuCl2, EuCl3 | GdCl3 | TbCl3 | DyCl2, DyCl3 | HoCl3 | ErCl3 | TmCl2 TmCl3 | YbCl2 YbCl3 | LuCl3 | |||
| AcCl3 | ThCl4 | PaCl5 | UCl3 UCl4 UCl5 UCl6 | NpCl4 | PuCl3 | AmCl2 AmCl3 | CmCl3 | BkCl3 | CfCl3 | EsCl3 | Fm | Md | No | LrCl3 | |||