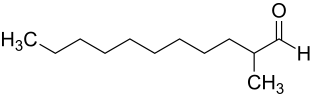
2-Methylundecanal
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methylundecanal | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C12H24O | ||||||||||||||||||
| Kurzbeschreibung | farblose Flüssigkeit mit fruchtigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 184,32 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig[2] | ||||||||||||||||||
| Dichte | 0,83 g·cm−3[2] | ||||||||||||||||||
| Siedepunkt | 171 °C[3] | ||||||||||||||||||
| Löslichkeit | löslich in Alkohol, unlöslich in Wasser[2] | ||||||||||||||||||
| Brechungsindex | 1,432 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Methylundecanal ist eine chemische Verbindung, die als erster vollsynthetischer Duftstoff 1921 in Chanel Nº 5 als Kopfnote bekannt wurde. Die Verbindung riecht krautartig, nach Orange und Ambra.[5] In hoher Verdünnung riecht es nach Honig und Nüssen. Die Verbindung ist eine farblose bis leicht gelbliche Flüssigkeit, die leicht in organischen Lösungsmitteln wie Ethern und Ethanol löslich ist.[6] Es wird als Duftstoff in Seifen, Reinigungsmitteln und Parfüms verwendet.
Vorkommen

2-Methylundecanal kommt natürlich in der Schale der Kumquat-Frucht vor.[7]
Chemische Eigenschaften und Gewinnung
2-Methylundecanal gehört zur Gruppe der aliphatischen Aldehyde.
Die Verbindung wurde zuerst von Georges Darzens im Jahre 1904 aus 2-Undecanon (Methylnonylketon) und Chloressigsäure mittels der Darzens-Reaktion synthetisiert.[8] Die Syntheseroute ist auch noch heute gebräuchlich.
Industriell werden zwei Synthesewege beschritten. Die eine Synthese erfolgt dabei über die Reaktion von 2-Undecanon und Alkylchloracetat unter Verseifung und Decarboxylierung.[9][10]
Die zweite Methode beginnt mit der Umwandlung von Undecanal mit Formaldehyd in Gegenwart einer Base gefolgt von einer Hydrierung. Das Ausgangsmaterial Undecanal ist aus 1-Decen über Hydroformylierung zugänglich.
Stereoisomerie
2-Methylundecanal enthält ein Stereozentrum, es gibt also zwei Enantiomere, (R)-2-Methylundecanal (oben) und (S)-2-Methylundecanal (unten):
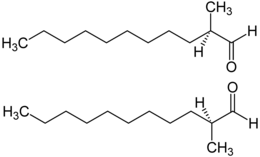
Die Enantiomere sind mittels Enders-Reagenz (SAMP/RAMP-Methode) gezielt herstellbar.[11]
Literatur
- John Emsley: Parfum, Portwein, PVC… Chemie im Alltag. 1. Auflage. Wiley-VCH, 2003, ISBN 3-527-30789-3.
Einzelnachweise
- ↑ Eintrag zu METHYLUNDECANAL in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. März 2020.
- ↑ a b c d thegoodscentscompany.com: Eintrag zu 2-methyl undecanal (aldehyde C-12 mna), abgerufen am 10. Juni 2013.
- ↑ a b Datenblatt 2-Methylundecanal bei Sigma-Aldrich, abgerufen am 9. September 2010 (PDF).Vorlage:Sigma-Aldrich/Name nicht angegeben
- ↑ a b Eintrag zu 2-Methylundecanal in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Molecule of the Month: Chanel No 5 and 2-methylundecanal.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-378.
- ↑ George A. Burdock: Encyclopedia of Food and Color Additives, Volume I. CRC Press, 1997, ISBN 0-8493-9416-3, S. 1878 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Comptes Rendus Hebdomadaires des seances de l'Academie des Sciences.
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. 7th edition Auflage. John Wiley & Sons Inc., Hoboken 2009. l.
- ↑ Kurt Bauer, Dorothea Garbe, Horst Surburg: Common fragrance and flavor materials. Wiley-VCH, 1997, S. 14 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieter Enders, Hubert Dyker: Synthesis and properties of the enantiomers of the two artificial fragrances lilial and methylundecanal. In: Liebigs Annalen der Chemie. 1990, S. 1107–1110, doi:10.1002/jlac.1990199001200.


















